प्रोटीन में बदलाव और उससे जुड़े चैपरॉन का अध्ययन करने का एक नया तरीका जो कि प्रोटीन को गैर-सजातीय संपर्क से बचाता है, इससे यह समझने में मदद मिल सकती है कि इसमें वास्तव में बदलाव किससे प्रेरित होता है। इस तरह की समझ होने से कैंसर, पार्किंसस और अल्जाइमर जैसी बीमारियों के बढ़ने की स्थिति को समझा जा सकेगा।
कोशिका में होने वाली लगभग हर प्रक्रिया में प्रोटीन की भागीदारी होती है। इसमें उन्हें उनके निर्धारित कार्य जिसे ‘सजातीय अनुरूपता’ कहा जाता है, के लिये ठीक ढंग से परिभाषित 3-डी संरचना को अपनाने की आवश्यकता होती है। लेकिन इस दौरान रासायनिक, पर्यावरण संबंधी और शारीरिक तनाव जैसी कई तरह की परिस्थितियों से प्रोटीन अणु गलत ढंग से मुड़ सकते हैं अथवा खुल सकते हैं जिसकी वजह से वह अपना कार्य ठीक ढंग से नहीं कर पाते। इसके परिणामस्वरूप कोशिका में विषाक्त पदार्थ एकत्रित हो जाता है जिससे बीमारियां होती हैं। अल्जाइमर अथवा पार्किंसस जैसी तंत्रिका तंत्र को क्षीण करने वाली न्यूरो-डिजनरेटिव बीमारियों को भी कोशिकाओं में विषाक्त पदार्थ एकत्रित होने से जोड़ा जाता रहा है।
जबकि कई नये परिवर्तित प्रोटीन स्वतः ही मुड़ सकते हैं, फिर भी उनमें से कइयों को अपने मूल रूप को हासिल करने और गैर-सजातीय अंतःक्रियाओं से बचने के लिये आणविक संरक्षिकाओं की मदद की जरूरत पड़ती है। प्रोटीन अणु ठीक ढंग से काम करें, इसके लिये अणुओं को संरक्षण देने वाले चैपरॉन आवश्यक होते हैं। ये उन्हें मुड़ने में मदद करने के साथ ही उनके खुलने और गलत ढंग से मुड़ने को भी ठीक करते हैं।
हमारे स्वस्थ्य रहने में अणु संरक्षिकाओं के महत्व को देखते हुये शोधकर्ता हमारी कोशिकाओं में उनकी संरचना और कामकाज का भी अध्ययन कर रहे हैं। थोक में जैव रासायनिक मापन से हमें प्रोटीन फोल्डिंग दक्षता और प्रोटीन फोल्डिंग के दौरान जब चैपरॉन उपस्थित होते हैं उस समय एकीत्रीकरण से बचाव के बारे में जानकारी मिलती है।
हालांकि, परंपरागत एकमुश्त प्रयोग से चैपरान अणुओं की विविधता और इनमें से प्रत्येक अणु अलग अलग कोशिका में किस प्रकार काम करता है इसकी जांच नहीं की जा सकती है। इसके साथ ही अल्पकालिक बदलाव की स्थिति ऐसे एकमुश्त प्रयोगों की जांच के दायरे में नहीं आती हैं। खानपान की पाचन संबंधी प्रक्रियाओं में इस प्रकार की अस्थायी स्थिति के महत्व के बारे में बहुत कम समझा गया है।
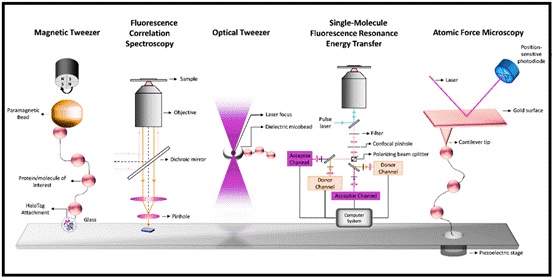
हाल के वर्षों में एकल अणु तकनीक के विकास ने विविध जैव रासायनिक प्रतिक्रियाओं में शामिल जैव- अणुओं के मौलिक गुणों का पता लगाने के लिये नये रास्ते खोले हैं।
प्रोफेसर शुभाशीष हल्दर के नेतृत्व में एस.एन. बोस नेशनल सेंटर फार बेसिक साइंसिज (डीएसटी का एक स्वायत्त संस्थान) की एक टीम उनकी प्रयोगशाला में तैयार सहसंयोजक चुंबकीय चिमटी (कोवेलेंट मैगनेटिक ट्वीजर – सीएमटी) का उपयोग करते हुये प्रोटीन अणुओं के भौतिक और रासायनिक गुणों और अणुओं के मुड़ने और काम करने के दौरान चैपरान्स की क्रिया का अध्ययन करने में उपयोग कर रही है।
इस नवीन दृष्टिकोण से चैपरान की सहायता से होने वाले प्रोटीन फोल्डिंग की जटिल प्रक्रिया को लेकर एक अप्रत्याशित अंतरदृष्टि उपलब्ध हुई है। अणुओं की इस समूची बैले प्रक्रिया में जो मुख्य कर्ताधर्ता हैं वह हीट शाॅक प्रोटीन एचएसपी70 और एचएसपी90 हैं, जो कि दो सबसे अधिक अध्ययन किये गये अणु संरक्षक चैपरान्स हैं।
एकल अणु बल स्पेक्ट्रोस्कोपी ने एचएसपी70- प्रेरित प्रोटीन परिचालन की जटिल गतिशीलता को उजागर किया है। यह जटिल ब्यौरा यह समझने के लिये महत्वपूर्ण है कि एचएसपी70 किस प्रकार से विभिन्न सेल्यूलर परिस्थितियों में प्रोटीन फोल्डिंग, स्थिरीकरण और परिवहन में मदद करता है।
एचएसपी90 भी एक महत्वपूर्ण संरक्षक है जो कि स्ट्रायड हार्मोन रिसेप्टर्स और सिग्नेलिंग किनेसेस सहित विभिन्न प्रोटीनों को सक्रिय और स्थिर करने के लिये जाना जाता है। एचएसपी90 काम्पलेक्स की बहुमार्गो और अवस्थाओं को चिन्हित करने के लिये एकल-अणु तकनीक का इस्तेमाल किया गया। इस शोध ने प्रोटीन संरचनाओं के जोड़तोड़ में चुबंकीय चिमटी की बहुमुखी क्षमताओं को उजागर किया है।
उनके निष्कर्षों ने आणविक चैपरान के नये तंत्रों का खुलासा किया है और प्रोटीन होमियोस्टेसिस और मानव रोगों में उनके कामकाज और प्रभाव के बारे में अंतरदृष्टि प्रदान की हे। इस पूरी अध्ययन श्रृंखला की समीक्षा ट्रेंड्स इन बायोकैम साइंसिज जर्नल में प्रकाशित हुई है।
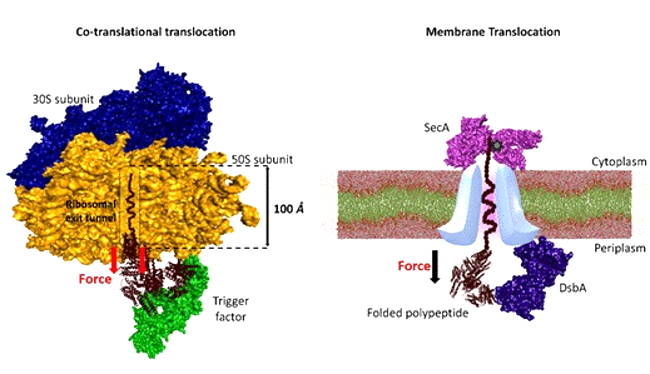
यह बल के तहत सबस्ट्रेट्स के साथ चैपरान की अंतःक्रियाओं में अंतर्निहित यांत्रिक गतिशीलता पर प्रकाश डालते हैं। और ये चैपरान विशेषतौर से जो कि सेल्यूलर सुरंग के भीतर स्थित सब्सट्रेट फोल्डिग को सुगम बनाने के लिये प्रोटीन स्थानांतरण के दौरान उत्पन्न बल का प्रयोग करते हैं।
सुरंग से जुड़े चैपरान्स फोल्डिंग प्रक्रिया को निर्देशित करने के लिये सुरंग से प्राप्त यांत्रिक उर्जा का उपयोग करते हैं, जिससे महत्वपूर्ण सेल्युलर कार्यों के लिये जरूरी प्रोटीन की उचित परिपक्वता सुनिश्चित होती है। इसके अलावा जांच से बल के दौरान चैपरान्स द्वारा प्रदर्शित विविध यांत्रिक कार्यों का पता चलता है।
शोधकर्ता अब यह समझने लगे हैं कि मस्तिष्क की कठोरता के कारण अल्जाइमर कैसे शुरू होता है। जब अल्जाइमर और पार्किंसंस जैसी क्षयकारी बीमारियों के भौतिक आधार को आणविक स्तर पर समझ लिया जाता है तो दवाओं को इस तरह से डिजाइन किया जा सकता है कि वह चैपरान की यांत्रिक भूमिकाओं को लक्षित कर सकें। इससे इन बीमारियों को बढ़ने से रोकना आसान हो जायेगा।
समीक्षा पत्र के सह-लेखक देबज्योति चैधरी कहते हैं, ‘ऐसे समय जब हम आधारभूत और बदलावकारी शोध के जंक्शन पर काम कर रहे हैं, अभी भी कई प्रश्न अनुत्तरित हैं।’ एक बार जब चैपरान्स और उनके क्लांइट प्रोटीन की गतिशीलता को समझने में जो अंतर है उसे समझ लिया जायेगा तो औषधि विज्ञान अगली छलांग के लिये तैयार हो जायेगा। इस पूरी क्रांति के मूल में एकल अणु तकनीक ही कुंजी है।
चैधरी एट अल, प्रोटीन फोल्डिंग में बैक्टीरियल चैपरान्स की यांत्रिक भूमिका का प्रत्यक्ष अवलोकन, एसीएस बायोमैक्रोमोलेक्यूल्स 2022.